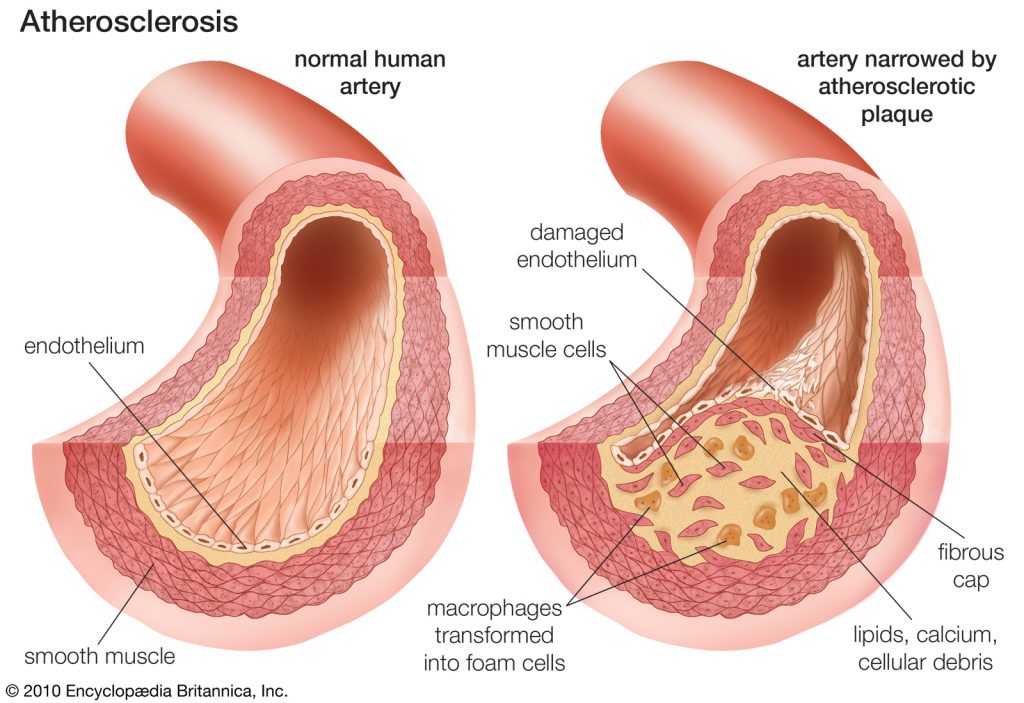
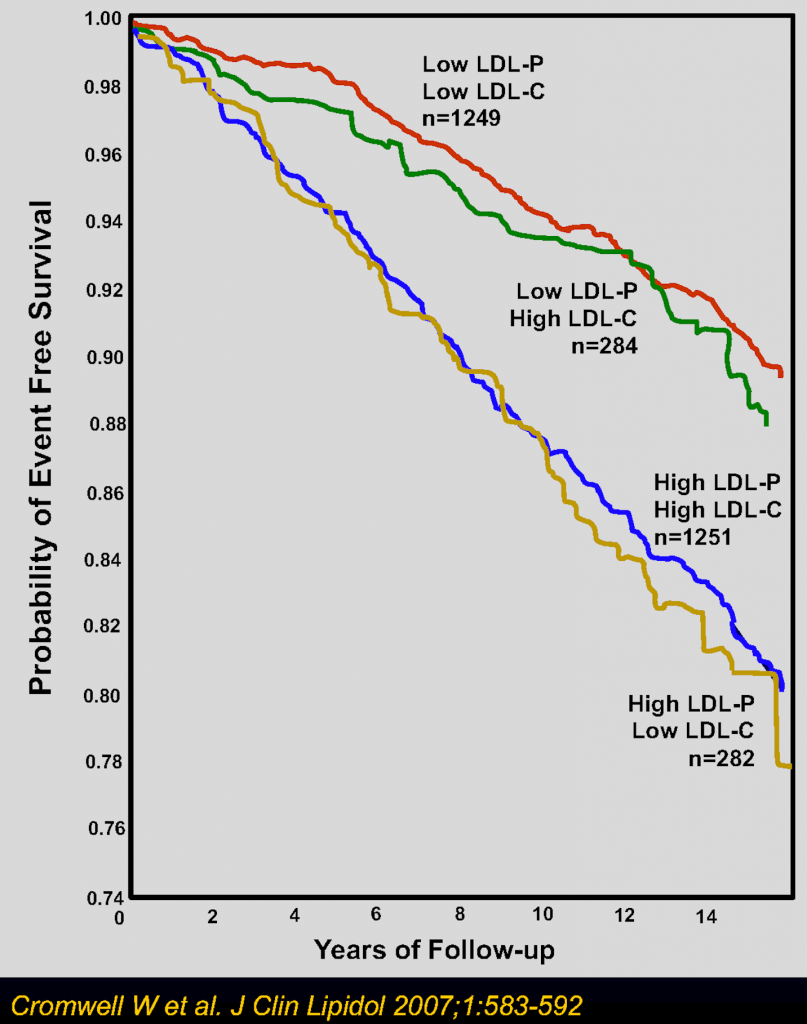
הקדמה
במאמר זה יוצגו יחסי הגומלין בין פחמימות, השמנה, וסוכרת סוג 2 (להלן – סוכרת).
מושגי יסוד
פחמימות
פחמימות (carbohydrates) הן קבוצה גדולה של פולימרים המכילה צרופים שונים של סוכרים, עמילן, ותאית.
| אין לנו את האנזימים הדרושים לפירוק תאית, לכן צמחים לא יכולים לשמש לנו כמזון. |
כל מולקולה של פחמימה בתזונה שלנו (סוכר לבן, תבואה ומוצריה, אורז, פירות, ירקות, חלב ומוצריו) מפורקת בתהליך העיכול לסוכרים פשוטים כמו גלוקוז (glucose), פרוקטוז (fructose), לקטוז (lactose), בטרם כניסתם למחזור הדם.
Glycogen
גליקוגן (glycogen) היא היא תצורת האחסון של גלוקוז בכבד ובשרירי השלד.

ציור 1 – מבנה סכימתי של מולקולת glycogen. הענפים מורכבים ממולקולות גלוקוז
הכבד יכול לאחסן 100-120 גרם גליקוגן, ושרירי השלד כ-400 גרם. הגליקוגן בכבד יכול לשמש את כל תאי הגוף, בעוד שהגליקוגן בשרירי השלד עומד לשימושם הבלעדי של השרירים.
אינסולין
האניסולין (insulin) הוא הורמון המייוצר בתאי ה-β בלבלב. זהו ההורמון האנבולי (בונה = anabolic) העיקרי בגופינו – ידו בכל ויד כל בו. האינסולין מווסת את תהליכי חילוף החומרים של הפחמימות, השומנים, והחלבונים. האינסולין אחראי על הספיגה של גלוקוז לתאי הגוף למיניהם. תפקיד נוסף של האינסולין, פחות מוכר אבל חשוב ביותר, הוא וויסות האחסון והשיחרור של חומצות שומן לתוך ומתוך תאי השומן.
גלוקגון
כולם מכירים את השם אינסולין. הגלוקגון (glucagon) לעומת זאת הוא הורמון "מוזנח" שממעטים להזכירו, בעוד שתפקידו בחילוף החומרים של גלוקוז ושומן הוא רב ביותר. הגלוקגון מייוצר ב-תאי ה-α בלבלב. תפקידו לשמור על רמת גלוקוז מספקת בדם כדי להבטיח את תפקודו התקין של המוח. ללא מספיק גלוקוז המוח קורס ומת (על גופי קיטון (ketone bodies) כתחליף לגלוקוז כמקור אנרגיה למוח – בהזדמנות אחרת).
לגלוקגון שלושה תפקידים עיקריים:
- לעורר את הכבד לפרק גליקוגן המאוחסן בו ולהזרים גלוקוז לדם
- להפעיל את מנגנון ה-gluconeogenesis הממיר חומצות אמינו לגלוקוז
- להפעיל את תהליך ה-lipolysis המשחרר שומנים מתאי השומן בגוף (מתואר בהמשך)
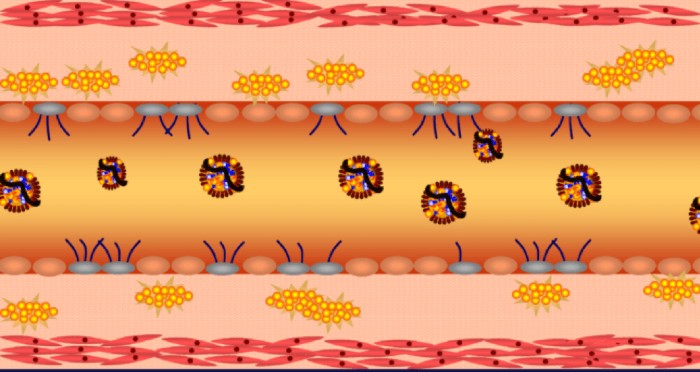
ספיגת גלוקוז
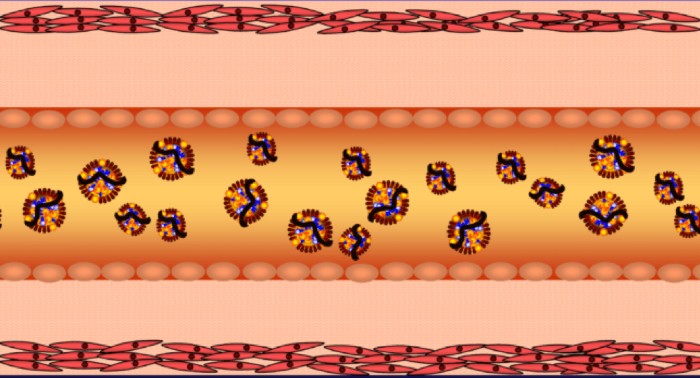
כאשר תא זקוק לגלוקוז (לייצור ATP) הוא מבטא על הממברנה שלו קולטן אינסולין (insulin receptor), ובסופו של תהליך מורכב, מולקולות גלוקוז נכנסות בדיפוזיה (דרך חלבון בשם GLUT4) מהדם לתוך נוזל התא.
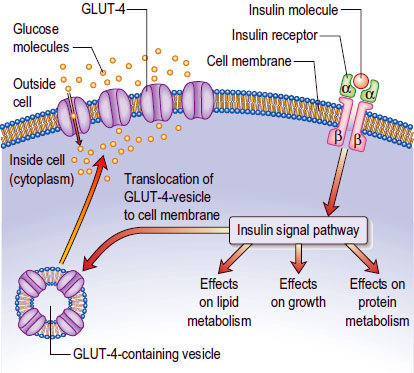
ציור 2 – תהליך ספיגת גלוקוז
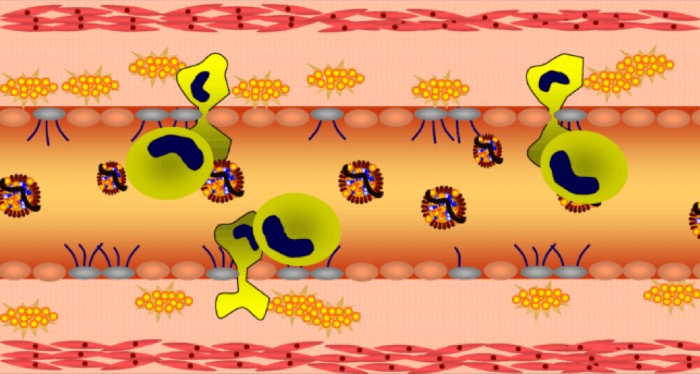
עמידות לאינסולין
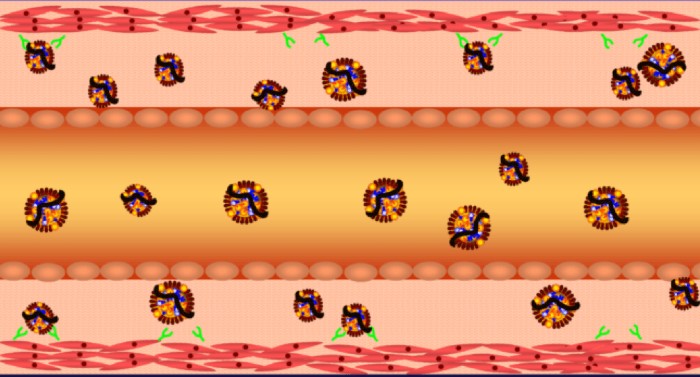
עמידות לאינסולין (insulin resistance) הוא מצב פתולוגי בו נפגעת יכולתו של תא להגיב נכון להמצאות אינסולין בדם, ולספוג גלוקוז לצרכיו. כתוצאה מכך רכוז הגלוקוז בדם לא יורד. מאחר שרמת גלוקוז גבוהה בדם היא מסוכנת, הלבלב ממשיך לייצר אינסולין כדי לנסות להורידה לרמה הנורמלית.
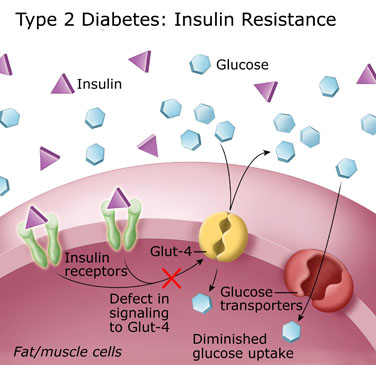
ציור 3 – עמידות לאיסולין
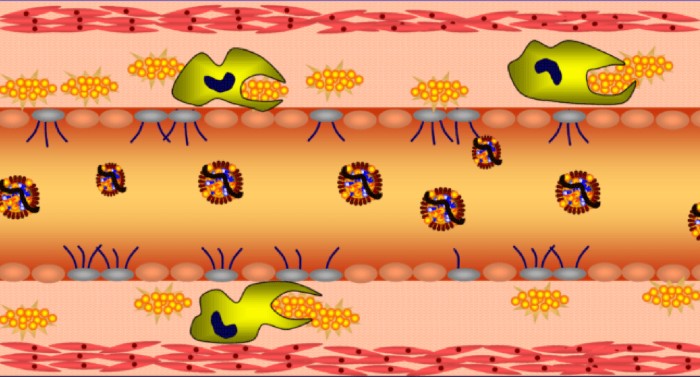
תאי שומן
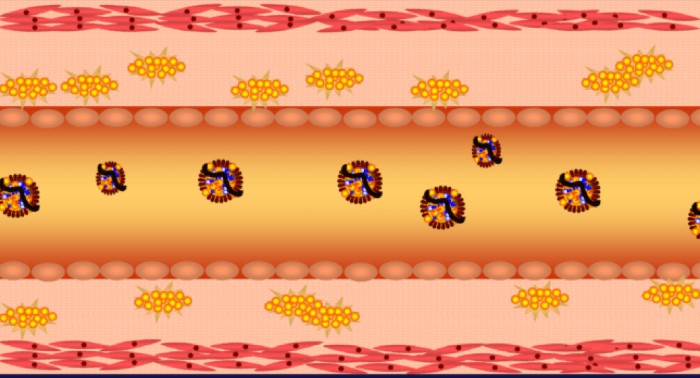
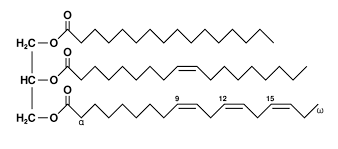
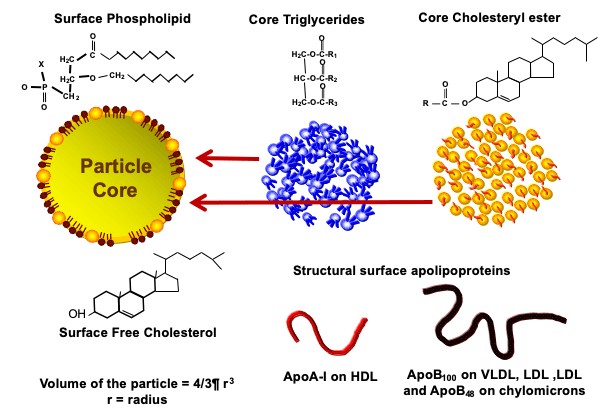
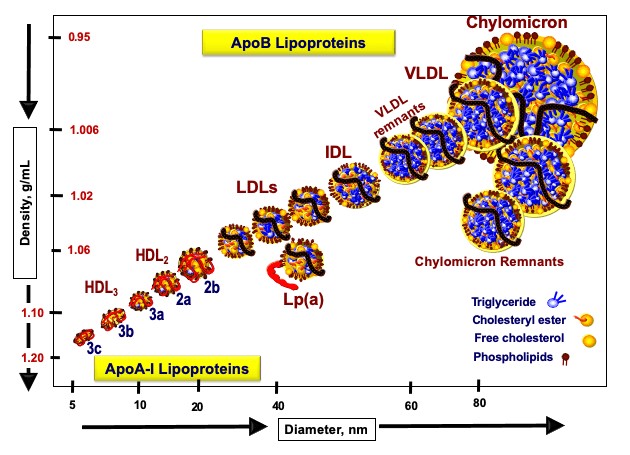
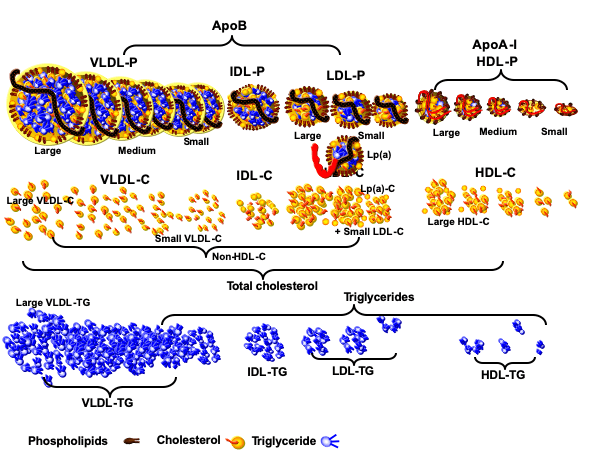
תאי השומן הם מאגר האנרגיה הגדול ביותר בגוף. מולקולות הטריגליצרידים (המובלות בדם על ידי חלקיקי VLDL ו-chylomicron) גדולות מידי מכדי לעבור דרך ממברנת התא. אנזים בשם lipoproteine lipase מפרק את הטריגליצריד למרכיביו (שלוש חומצות שומן ומולקולת גליצרול (glycerol)). חומצות השומן עוברות את ממברנת התא בתהליך דיפוזיה דרך חלבון בשם FATP – fatty acid transport protein.
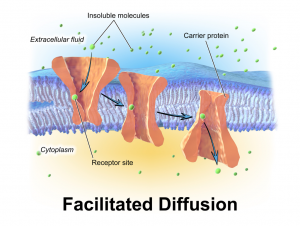
ציור 4 – העברת חומצות שומן לתוך תא שומן (FATP)
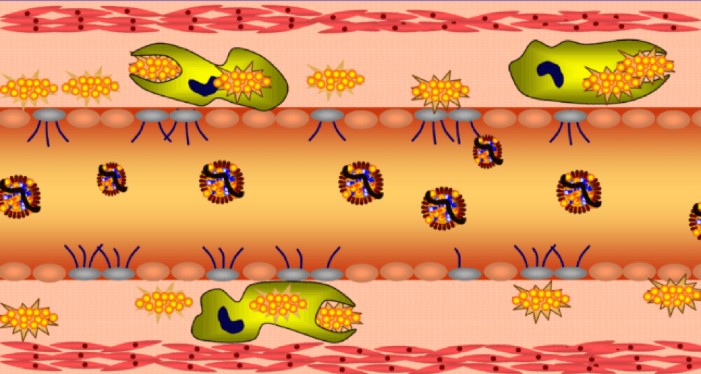
בתוך התא חומצות השומן מתחברות חזרה לטריגליצריד, ונשמרות בתצורה של טיפות שומן (lipid droplets).
כאשר תאי הגוף זקוקים לחומצות שומן, הורמון epinephrine או גלוקגון מתקשרים לקולטן שלהם ומתחיל תהליך רב-שלבי בשם lipolysis המפרק את הטריגליצריד חזרה לשלוש חומצות שומן וגליצרול, המשתחררים למחזור הדם.
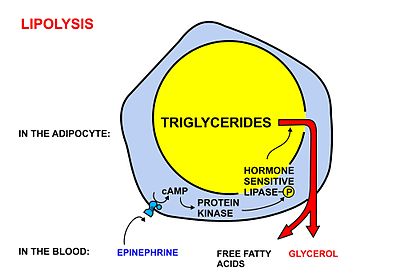
ציור 5 – Lipolysis
תהליך ה-lipolysis מופעל על ידי מספר הורמונים, ביניהם הגלוקגון. רמת אינסולין גבוהה מעכבת את תהליך ה-lipolysis ומונעת שחרור שומנים מתא השומן לדם.
השמנה
אכלנו ארוחה עשירה בפחמימות. מה קורה עכשיו?
- הפחמימות מפורקות על ידי מערכת העיכול לגלוקוז ונכנסות למחזור הדם
- תאי ה-β של הלבלב מזהים את העליה בריכוז הגלוקוז, ומפרישים אינסולין
- תאים הזקוקים לאנרגיה מבטאים קולטן אינסולין וסופגים גלוקוז
- אם רכוז הגלוקוז עדיין גבוה, הוא מועבר למאגרי הגליקוגן בכבד ובשרירי השלד
- כאשר מאגרי הגליקוגן מלאים, ועדיין יש רכוז גבוה של גלוקוז בדם, הכבד ממיר גלוקוז לחומצת שומן רווי בשם palmitic acid, ומרכיב טריגליצרידים של שומן רווי.
| palmitic acid מהווה 20-30% של מאגרי השומן בגוף, וכן 17-25% מהשומנים ב-חלב אם.
מסכנים התינוקות. מאכילים אותם בשומן רווי ומגדילים את הסיכון שלהם לחלות במחלת לב. אנחנו אמורים להאמין כי שומן רווי מזיק לבריאות? – לא נראה לי. |
- הכבד אורז את הטריגלצרידים בתוך חלקיקי VLDL ומשחררם לדם. בהגיעם לתאי שומן השומן מוכנס לאיחסון. חלקיקי ה-VLDL מתכווצים והופכים לחלקיקי LDL (להזכירכם, VLDL הוא המקור היחיד ל-LDL).
- כל זמן שרמת האינסולין בדם גבוהה, נמנע שיחרור שומנים מתאי השומן לדם.
| רוצה לומר: יותר פחמימות ← יותר VLDL ← יותר שומן כלוא בתאי השומן, ויותר חלקיקי LDL בדם – הסיקו לבד את המסקנות. |
סוכרת
המודל המקובל להתפתחות סוכרת סוג 2 כולל את השלבים הבאים:
- אתה אוכל יותר מידי
- אתה משמין
- ככל שאתה שמן יותר, גדלה העמידות לאינסולין
- רמת האינסולין בדם עולה כדי להתגבר על העמידות ולהוריד את רמת הגלוקוז
- בשלב מסוים העמידות גוברת, ורמת הגלוקוז נשארת גבוהה
- אתה חולה בסוכרת
אין ספק כי השמנה, עמידות לאינסולין, וסוכרת כרוכים זה בזה, אבל יש בעיה במודל הזה. נמחיש זאת על ידי שתי דוגמאות.
הראשונה, האנשים הרזים ביותר בעולם הסובלים ממחלה גנטית נדירה מאד בשם congenital generalized lipodystrophy. לאנשים האלה אין תאי שומן כלל. אין שומן ← אין עמידות לאיסולין ← אין סוכרת – נכון? לא נכון, הם כולם (100%) חולים בסוכרת. בהעדר תאי שומן אין להם יכולת לאגור עודפי אנרגיה, העמידות לאינסולין גבוהה מאד, ולכן רמת הגלוקוז גבוהה.
השניה, האנשים השמנים בעולם – מתאבקי הסומו. הם אוכלים כמויות אדירות של אורז ושותים כמויות גדולות של בירה (דיאטה של 20,000 קלוריות ליום). השמנה קיצונית ← עמידות לאינסולין ← סוכרת – נכון? לא נכון, למתאבקי הסומו (כל זמן שהם פעילים) אין סוכרת כלל (0%). בזכות הפעילות הגופנית האינטנסיבית שלהם, מאגרי הגליקוגן שלהם בכבד ובשרירים מתרוקנים ולא מתפתחת עמידות לאינסולין.
המסקנה המתבקשת היא כי השמנה איננה תנאי הכרחי (דוגמה ראשונה) או מספיק (דוגמה שניה לסוכרת.
הגורם הראשוני בשרשרת המובילה לסוכרת היא רמה גבוהה של אינסולין, הגוררת עמידות לאינסולין. במצב זה רמת הגלוקוז נשארת גבוהה, הכבד ממיר אותו לשומן רווי המוכנס לתאי שומן ללא יכולת לצאת.
לכן מודל הסוכרת צריך להראות כך:
- אתה אוכל יותר מידי פחמימות וסוכרים
- רמת האינסולין עולה
- שומן נאגר בתאי השומן
- מתפתחת עמידות לאיסולין
- העמידות מחמירה ואתה מאובחן כחולה סוכרת
| אותם מרכיבים, סדר קצת שונה. בכל מקרה מחלה קשה הניתנת למניעה בתזונה נכונה (ומנסיוני האישי, גם לריפוי מלא). |


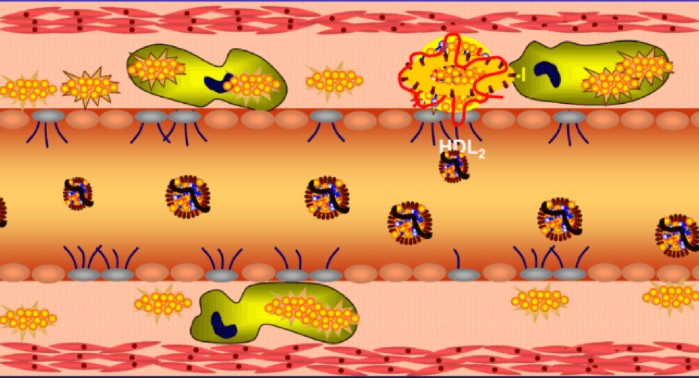
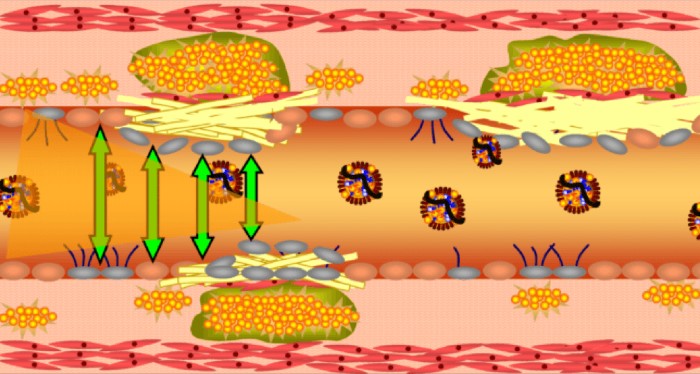
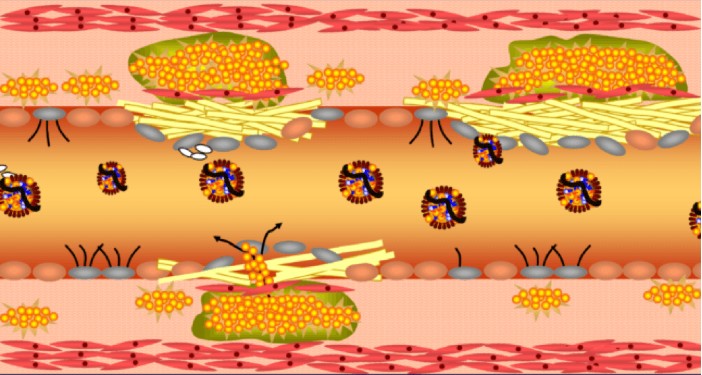
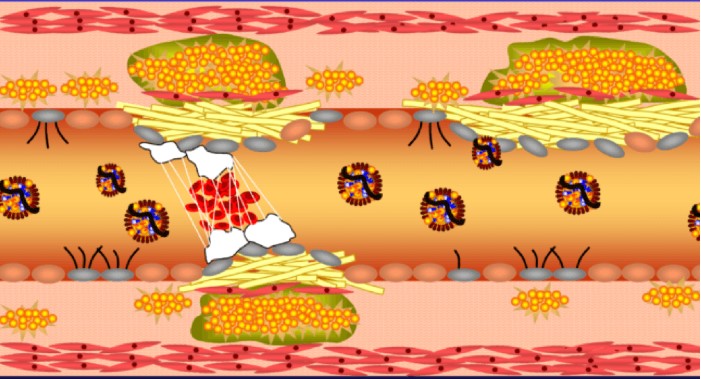
 חלק שני: איך נוצרת טרשת עורקים – הדעה המקובלת
חלק שני: איך נוצרת טרשת עורקים – הדעה המקובלת